首先介绍一下时下最好的基因编辑技术CRISPR/CAS系统。
CRISPR/Cas系统是细菌和古细菌中进化出来用于抵御噬菌体及外源DNA入侵的适应性免疫系统,通过CRISPR RNA (crRNA)和trans-activating crRNA (tracrRNA)以及Cas9蛋白组成的复合体抵御外源性DNA的入侵。当外源基因入侵时,该防御系统的 CRISPR 序列会表达与入侵基因组序列相识别的 RNA,然后 CRISPR 相关酶(Cas)在序列识别处切割外源基因组DNA,从而达到防御目的。
组成单元:由Cas9蛋白和sgRNA(single guide RNA)组成,sgRNA是根据crRNA和tracrRNA形成的高级结构设计的。人工设计的gRNA( guide RNA)来识别目的基因组序列,并引导Cas9蛋白酶进行有效切割DNA双链,形成双链断裂,损伤后修复会造成基因敲除或敲入等。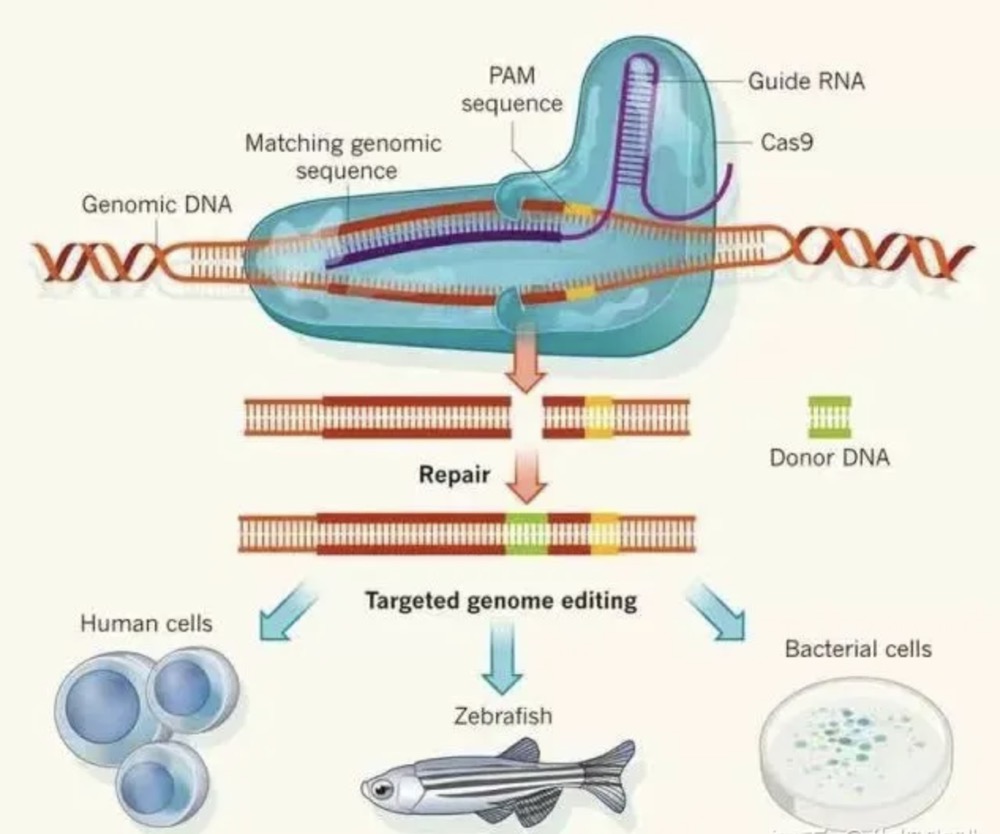
如果要基因编辑,那递送系统也变得非常关键。基因编辑药物从体外的细胞治疗往直接体内治疗过渡的过程中,对递送载体提出了更高的要求,递送载体成了体内基因编辑药物临床应用的关键限速步骤。目前针对递送载体的研究主要集中于蛋白质递送系统和核酸递送系统。在蛋白质递送系统方面,越来越多的研究聚焦于蛋白质递送载体的优化和改造,也有研究探索新型蛋白质递送系统。在核酸递送系统方面,主要的方法又分为病毒载体和非病毒载体两种。
相对成熟的病毒递送系统,例如AAV,由于其在体内极长的表达时间,如若用于基因编辑器的递送,有很大的安全隐患;而以LNP为主的非病毒递送系统在mRNA递送方面已经展现出了巨大的潜力,在肌肉注射(如mRNA疫苗)和肝脏递送(如递送基因编辑器mRNA的体内基因编辑药物)等方面展示出了很好的成药性以及出色的临床结果,但是开发精准肝脏外靶向的非病毒递送载体,治疗例如神经系统疾病的新一代mRNA或者基因编辑药物,仍然缺乏接近临床转化的重大突破。
精准、灵活的细菌“注射器”实现蛋白质精准递送。
内共生细菌是一类特殊的细菌,可以寄生在宿主细胞内部,它已经进化出复杂的递送系统,使其能够分泌调节宿主细胞的生物因子。细胞外收缩注射系统(eCIS)就是一个例子,它是一种类似注射器的大分子复合物,可以通过在细胞膜表面诱导出一个刺突蛋白,从而将携带的蛋白质有效载荷注入到真核细胞中。
PVC(Photorhabdus virulence cassette )有效载荷蛋白的N端高度无序区域是其“包装结构域”,只要将其与想要递送的蛋白融合,就能将其加载到PVC复合体中。随后,他们利用预测蛋白质结构的人工智能程序AlphaFold设计了修改尾部纤维蛋白(PVC13)的方法,使其能够精准地靶向人类细胞表面表达的不同蛋白。
通过对eCIS的进一步改造,可以使用这一系统递送不同类型的蛋白载荷,他们已经在体外实验中成功递送了CRISPR基因编辑系统中的Cas9蛋白以及另一类用于基因编辑的锌指蛋白。在小鼠的体内实验中,这种经过改造的递送系统也可以将蛋白递送到小鼠大脑的神经元中。
具有高度靶标特异性,但效率有待提升
PVC递送系统表现出高度的靶标特异性,能有效地将载荷递送到拥有特定表面受体的细胞中。尤其是在人和小鼠细胞的靶向特异性测试中,展现了接近100%的靶向特异性。另一方面,该系统的靶向特异性可以通过对尾部纤维蛋白的合理改造来实现,这表明PVC展现出的高特异性是便于改造和拓展的,这给利用该系统进行细胞或组织特异性的体内蛋白靶向递送提供了广阔的想象空间。
该递送系统具有良好的安全性基础。PVC处理不会产生任何显著的免疫细胞激活、炎性细胞因子的产生、体重减轻或细胞毒性,表明PVC处理在该实验时间过程中没有免疫原性或毒性。同时,颅内注射后,PVC在大脑中只是短暂存在,不会持续很长时间。长期的安全性仍然需要更多谨慎细致的研究才能确定,尤其是系统性给药的免疫原性如何尚不明了。
在将这一系统应用于人类治疗之前,需要解决的最主要问题之一是确保递送系统在人体内的安全性和有效性。首先需要进行更多体内试验,以了解其生物相容性和药物代谢动力学,以及在不同的生物体内的生物分布和递送效果。其次,需要进一步开发和优化PVC系统的设计,以提高其蛋白递送效率和靶向准确性。
这一递送系统的递送效率仍有待提升。该研究中展示的基于PVC的递送系统进行体外细胞系基因编辑的效率仅有12%左右,距离各种疾病使用基因编辑进行治疗的效率阈值仍有差距。如果要将该递送技术应用于体内,考虑到递送损耗以及体内细胞所处环境的复杂性,该递送系统所产生的编辑效率可能会进一步下降。
与目前常用的AAV载体相比,基于PVC的递送系统颗粒大小(约116nm)相较于前者(约25nm)较大,和纳米脂质体颗粒(LNP,约60-200nm)大概相当。过大的包装体积,可能给体内实质组织中的深层细胞的高效率递送造成一定的困难。该系统的包装递送效率可能也会受到载荷蛋白大小的影响,这可能是该递送系统针对体外细胞的编辑效率过低的一个可能的原因。现有的高效基因编辑工具相较于目前常用的递送工具的有效容量来说普遍偏大,这对包括新开发的PVC系统等胞外压缩注射系统仍然是一个暂未克服的挑战。







